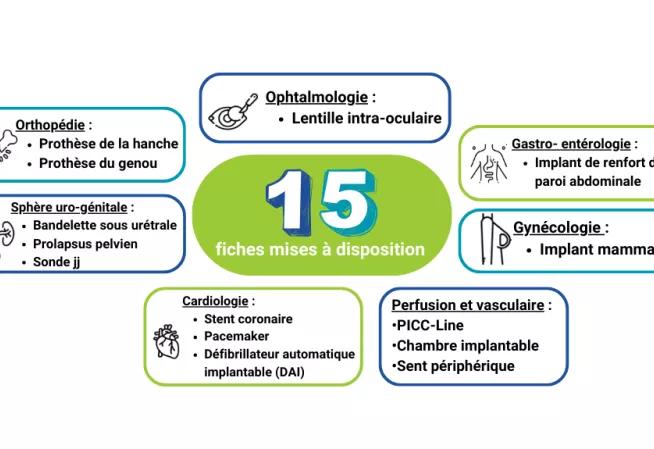
1. Types d'ATU
Il existe deux types d’ATU :
- Les ATU de cohorte : elles sont demandées par un laboratoire lorsque, pour un produit, ses données thérapeutiques (en vue d’une demande d’AMM) indiquent une forte présomption d’efficacité et de sécurité.
- Les ATU nominatives : elles sont demandées par le prescripteur pour un patient précis, qui ne peut participer à une recherche biomédicale. La présomption d’efficacité et de sécurité se déduira ici des connaissances scientifiques.
2. Référentiels disponibles et codage des indications des médicaments sous ATU / post-ATU
Sur le site internet de l’ANSM sont présentés, conformément à l’article R.5121-73 du CSP :
- les protocoles d’utilisation thérapeutique et les résumés des rapports de synthèse,
- la liste des médicaments faisant l’objet d’une ATU de cohorte ou d'une ATU nominative ainsi que la liste des médicaments pour lesquels l’autorisation a été refusée, suspendue ou retirée.
Un code indication est instauré pour les médicaments sous ATU et en post-ATU selon la note d'information N° DGOS/PF4/DSS/1C/2019/73 du 2 avril 2019 et le décret du 3 mai 2019 relatifs à la mise en œuvre du codage de l’indication dans laquelle un médicament bénéficiant d’une prise en charge au titre d’une autorisation temporaire d’utilisation ou du dispositif « post-ATU » est prescrit.
Les référentiels des codes UCD et indications des spécialités bénéficiant d’une ATU et des spécialités en post-ATU sont disponibles et mis à jour mensuellement par le Ministère, dans le paragraphe « Le financement des médicaments sous autorisation temporaire d’utilisation ».
Les spécialités sous ATU nominative ont un code unique : NXXXX00
Les établissements prescripteurs et utilisateurs d'ATU sont soumis aux déclarations des codes indications via le PMSI selon le calendrier suivant :
- en intra-hospitalier : Le code indication dans FICHCOMP-ATU sera obligatoire à compter du 1er septembre 2019 pour permettre la valorisation de ces médicaments
- en rétrocession : Le code indication dans le RSF des actes et consultations externes (RSF-ACE) sera nécessaire à compter du 1er janvier 2020 pour la valorisation de ces médicaments
3. Demande d'ATU
Les ATU, qu’elles soient de cohorte ou nominatives, doivent faire l'objet d'une demande à l’ANSM. Elles sont accordées pour une durée déterminée, ne pouvant excéder un an, et peuvent être renouvelées.
ATU de cohorte
Les formulaires de demande et de renouvellement d'ATU de cohorte sont disponibles sur le site de l'ANSM.
ATU nominative
De nouvelles modalités de traitement des demandes d'autorisations temporaires d'utilisation (ATU) nominatives, délivrées par l'Agence Nationale de Sécurité des Médicaments (ANSM), sont entrées en vigueur depuis le 17/09/2018.
Depuis le 17 septembre 2018,
- La prescription doit s'appuyer sur le référentiel des spécialités délivrées dans le cadre des ATU nominatives.
- Un nouveau formulaire de demande d'ATUn a été créé pour lequel un guide d'aide au remplissage pour les prescripteurs est disponible.
- Un numéro de fax unique pour adresser à l'ANSM le formulaire et la fiche de suivi PUT quand la spécialité en ATUn est soumise à un PUT : 01 55 87 36 12.
Depuis le 4 mars 2019, toutes les demandes d’ATU nominatives peuvent être transmises à l’ANSM avec l'application e-Saturne (dématérialisation des demandes). L’application est accessible à tous les professionnels de santé (médecins, pharmaciens, internes en médecine) via leurs cartes CPS. Toutes les demandes d’ATUn pourront alors être transmises à l’ANSM avec cette application.
Dès septembre 2019, les demandes d’ATUn qui seront envoyées à l’ANSM par fax ne seront traitées que dans un régime dérogatoire relevant de situations exceptionnelles. L'application e-Saturne remplacera complètement la communication par fax en 2020.
La note d'information N°DGOS/PF4/2019/31 du 07 février 2019 détaille les modalités d'utilisation de cette application.
4. Financement
Les médicaments bénéficiant d’une ATU sont pris en charge à 100% par l’assurance maladie. Ils sont fournis à l’établissement de santé par le laboratoire titulaire des droits d’exploitation, à titre gracieux ou moyennant une indemnité dont le montant est librement fixé par le laboratoire.
Depuis le 1er Janvier 2017 (loi de financement de la sécurité sociale de 2017), le financement des ATU se fait en sus du GHS, au fil de l’eau. Le montant remboursé est le prix d’achat indiqué par l’établissement, toutes taxes comprises.
Pour cela, les établissements publics et la majorité des établissements privés participant au service public hospitalier, doivent déclarer l’ensemble des prescriptions des médicaments sous ATU administrés à l’hôpital à travers l’outil FICHCOMP du PMSI, grâce au codage de ces derniers par Unité Commune de Dispensation (code UCD).
Pour les établissements privés à but lucratif ou non lucratif mais ne participant pas au service public hospitalier, le financement est effectif après facturation à la CNAMTS via le bordereau S.34.04.
Concernant les médicaments sous ATU rétrocédés, le taux de remboursement est aussi de 100%. Le prix facturé tient compte de la TVA applicable (2,1%) et de la marge forfaitaire par ligne de prescription.
5. Indemnités
Le montant des indemnités des ATU est fixé librement par le laboratoire.
L’article L.162-16-5-1 du Code de la sécurité sociale prévoit que le titulaire des droits d’exploitation du médicament déclare au comité économique des produits de santé (CEPS) :
- Dans le mois qui suit l’octroi de l’ATU par l’ANSM : le montant maximal de l’indemnité qu’il réclame aux établissements de santé, même si ce montant est nul. Ces montants sont publiés sur le site du CEPS et le tableau est actualité trois fois par an.
- Le 15 Février de chaque année : le chiffre d’affaire du laboratoire correspondant aux médicaments sous ATU ainsi que le nombre d’unités fournies au titre de l’année civile précédente.
6. Arrêts de prise en charge au titre d'une ATU
Le laboratoire exploitant un médicament qui bénéficie d’une ATU doit avoir déposé ou s’engager à déposer une demande d’autorisation de mise sur le marché (AMM) dans un délai déterminé. Ce délai a été fixé à un an (article D. 5121-32 du code de la santé publique).
L’article 97 de la loi de financement de la sécurité sociale (LFSS) pour 2017 prévoit la possibilité de mettre fin à la prise en charge d’un médicament au titre de son ATU lorsque le laboratoire n’a pas déposé une demande d’AMM dans l’année suivant l’octroi de l’ATU ou qu’il n’a pas respecté ses engagements à déposer cette demande.
La note d'information interministérielle n°DGOS/PF2/PF4/DGS/PP2/DSS/1C/2019/39 du 18 février 2019 précise les modalités relatives à l’arrêt de la prise en charge dérogatoire dont bénéficie certains médicaments qui font l’objet d’une autorisation temporaire d’utilisation (ATU), lorsque les conditions et engagements prévus à l’article L. 5121-12 du code de la santé publique (CSP) n’ont pas été ou ne sont plus respectés.
A ce jour, deux spécialités sont concernées :
- QIZENDAY (biotine)
- PROHIPPUR (benzoate de sodium)
Elles ne seront plus pris en charge au titre d'une autorisation temporaire d'utilisation à partir du 15 avril 2019.
| Article R.5121-68 du CSP |
Précise les conditions de demande d’une ATU et les obligations du laboratoire et de l'établissement en terme de documents à fournir à l'ANSM. |
| Article R.5121-69 du CSP | Précise que la demande du prescripteur tendant à obtenir l’ATU est adressée à l’ANSM par le pharmacien gérant la PUI d’un établissement de santé (en cas de maladie grave ou rare et en l’absence de traitement approprié). |
| Article R.5121-70 du CSP | Définit le protocole d’utilisation thérapeutique (nécessaire à la mise en place d'une ATU) et les modalités de recueil d’informations entre le laboratoire et l’ANSM. |
| Articles R.5121-71 et R.5121-72 du CSP | Précise que le directeur de l’ANSM est chargé de statuer sur la demande d’ATU |
| Article R.5121-76 et R.5121-74 du CSP. |
Précise les conditions de renouvellement d'une ATU et la cessation d'effet par le directeur de l'ANSM si le médicament a obtenu une AMM. |
| Article L. 162-16-5-1 du code de la sécurité sociale | Précise que le CEPS doit rendre public le montant de l’indemnité maximale que les laboratoires peuvent demander aux établissements de santé pour les produits en ATU ou en post-ATU. |
|
Note d'information N° DGOS/PF4/2019/31 du 7 février 2019 |
Relative à la dématérialisation des demandes d’autorisation temporaire d’utilisation nominative |
|
Note d'information N°DGOS/PF2/PF4/DSS/1C/ DGS/PP2/ /2019/39 du 18 février 2019 |
Relative à l’arrêt de la prise en charge de certains médicaments au titre d’une autorisation temporaire d’utilisation |
| Note d'information N° DGOS/PF4/DSS/1C/2019/73 du 2 avril 2019 | Relative à la mise en œuvre du codage de l’indication dans laquelle un médicament bénéficiant d’une prise en charge au titre d’une autorisation temporaire d’utilisation ou du dispositif « post-ATU » est prescrit |
|
Décret n°2019-410 du 3 mai 2019 |
Portant application de l’article L. 162-16-5-3 du code de la sécurité sociale en matière de prise en charge d’une spécialité au titre des articles L. 162-16-5-1-1 et L. 162-16-5-2 du code de la sécurité sociale. Il précise les conditions d’application de l’article L. 162-16-5-3 du CSS conditionnant la prise en charge d’une spécialité faisant l’objet d’une ATU ou bénéficiant du dispositif «post-ATU» à la transmission de l’indication pour laquelle ladite spécialité a été prescrite. |