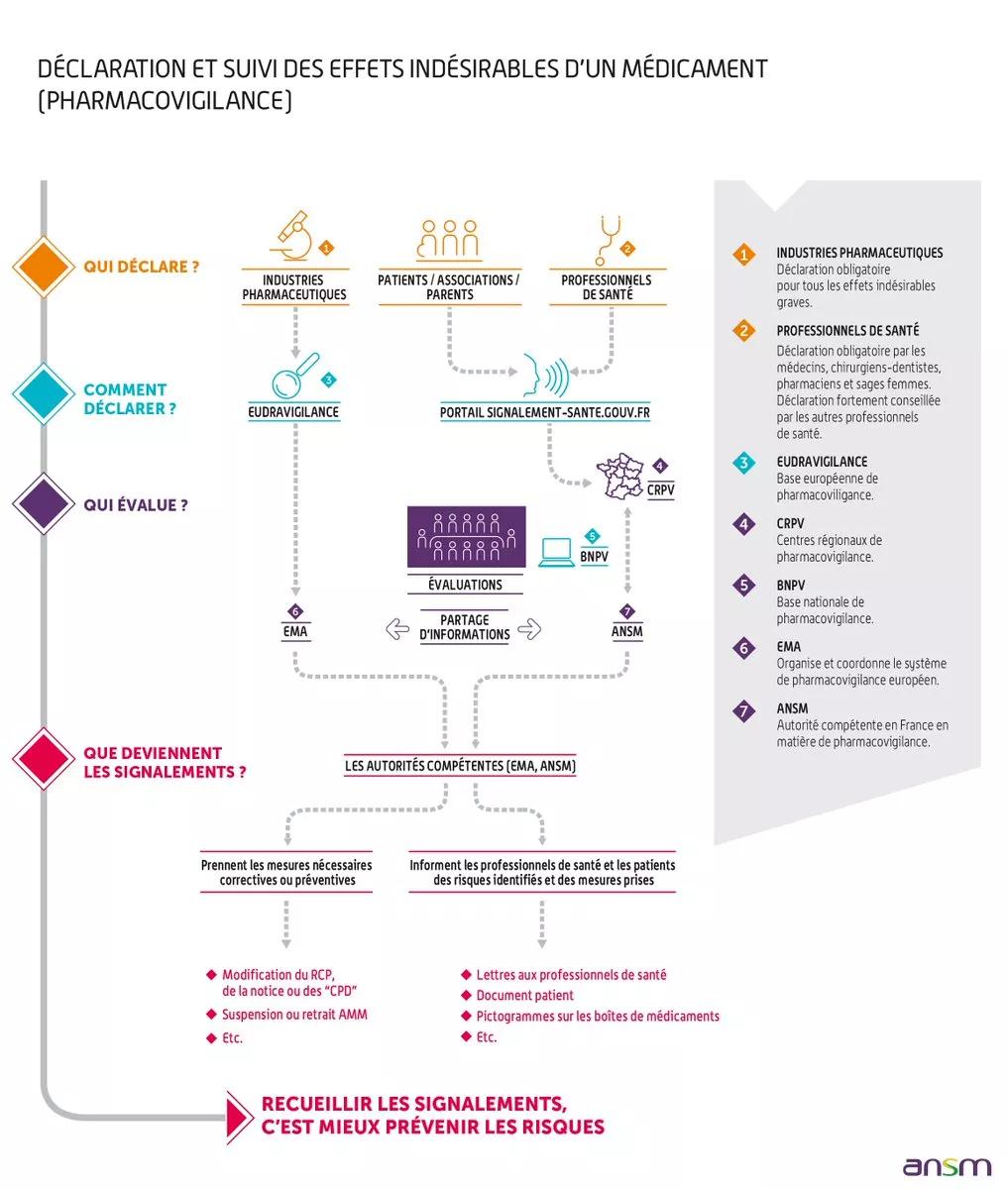
Définition
La pharmacovigilance est la surveillance des médicaments et la prévention du risque d’effet indésirable résultant de leur utilisation.
Elle repose sur :
- Le recueil des effets indésirables par les professionnels de santé, les patients et associations agréées de patients et les industriels avec l’appui du réseau des centres régionaux de pharmacovigilance. Ce recueil est basé sur la notification spontanée
- L’enregistrement et l'évaluation des notifications
- La mise en place d'enquêtes ou d'études pour analyser les risques, la participation à la mise en place et au suivi des plans de gestion des risques
- L’appréciation du profil de sécurité d’emploi du médicament en fonction des données recueillies
- La prise de mesures correctives (précautions ou restriction d’emploi, contre-indications, voire retrait du produit) et la communication vers les professionnels de santé et le public
- La communication et la diffusion de toute information relative à la sécurité d'emploi du médicament
- La participation à la politique de santé publique de lutte contre la iatrogénie médicamenteuse
La pharmacovigilance s’appuie sur une base réglementaire nationale et européenne.
Organisation
Le système de pharmacovigilance est organisé selon :
- Un échelon national piloté par l'ANSM
- Un échelon régional, les centres régionaux de pharmacovigilance (CRPV)
Les effets indésirables sont évalués par le CRPV et enregistrés sous forme anonymisée dans la Base Nationale de Pharmacovigilance (BNPV), puis transmis à l'ANSM.
Les médecins, les sages-femmes, les chirurgiens-dentistes et les pharmaciens doivent déclarer immédiatement tout effet indésirable suspecté d’être dû à un médicament ou à un produit de santé dont ils ont connaissance, qu'il soit grave ou non grave, connu ou non connu, au centre régional de pharmacovigilance dont ils dépendent (articles L. 5121-25 et R. 5121-161 du code de la santé publique)
Tout autre professionnel de santé ayant observé un effet indésirable susceptible d’être dû à un médicament ou à un produit peut également en faire la déclaration auprès du centre régional de pharmacovigilance dont il dépend.
Les patients et les associations agréées de patients peuvent déclarer les effets indésirables suspectés d’être dus à un médicament ou à un produit de santé dont ils ont connaissance au centre régional de pharmacovigilance.
Le portail de signalement des événements sanitaires indésirables permet de déclarer l’ensemble des événements sanitaires indésirables suspectés d’être liés aux produits de santé, produits de la vie courante et actes de soins en choisissant l'option "Je suis un particulier" ou "Je suis un professionnel de santé" selon le cas.
Elle sera automatiquement transmise au centre régional de pharmacovigilance dont la personne ayant présenté l’effet indésirable dépend géographiquement.
Une déclaration sur formulaire Cerfa est également possible. Elle est à transmettre par courrier postal, fax ou email au Centre régional de pharmacovigilance (CRPV) dont dépend géographiquement le déclarant.
Pour information, une déclaration doit comporter au minimum les informations suivantes :
une source identifiable (le notificateur ou le déclarant)
un patient identifiable
le nom du médicament suspecté et le numéro de lot (indispensable pour la traçabilité du médicament dérivé du sang, un vaccin ou tout problème de qualité du produit)
la nature de l’effet indésirable.
En pratique, pour être évaluée correctement, la déclaration doit comprendre des informations sur le patient (sexe, âge, poids, taille, département de résidence, antécédents, profession, etc...), les médicaments pris (dénomination, numéro de lot, posologie, voies d’administration, date de début et de fin de traitement, indication etc...), l’effet indésirable (description, date d’apparition, durée, évolution etc...).
La déclaration peut être associée à des copies de compte-rendu d’hospitalisation, de courriers médicaux et d’examens complémentaires (biologie, imagerie...)
Le notificateur pourra être recontacté par un praticien du Centre Régional de Pharmacovigilance si un suivi est nécessaire ou pour obtenir des informations complémentaires.
Une déclaration de pharmacovigilance est un dossier évolutif dans le temps. A tout moment, après obtention de nouvelles informations, la déclaration initiale pourra être complétée.
Toutes les informations fournies seront traitées par le CRPV dans le respect de la confidentialité des données et du secret médical et professionnel, et anonymisées (seules les initiales, l'âge (et/ou la date de naissance) et le sexe seront enregistrés dans la base nationale de pharmacovigilance).
Coordonnées des CRPV de la Région Grand Est
| CRPV Nancy | Centre Régional de Pharmacovigilance Hôpital Central 29, avenue du Maréchal de Lattre de Tassigny 54035 NANCY CEDEX | M. le Pr Pierre Gillet Téléphone : 03.83.85.27.60 Télécopie : 03.83.32.33.44 e-mail: crpv@chru-nancy.fr |
| CRPV Strasbourg | Centre Régional de Pharmacovigilance Hôpital Civil 1, place de l'Hôpital - B.P. n°426 67091 STRASBOURG CEDEX | Mme le Dr Martine Tebacher-Alt Téléphone : 03.88.11.64.80 Télécopie : 03.88.11.67.26 e-mail: pharmacovigilance@chru-strasbourg.fr |
| CRPV Reims | Centre Régional de Pharmacovigilance Hôpital Robert Debré Avenue du Général Koenig 51092 REIMS CEDEX | M. le Pr Thierry Trenque Téléphone : 03.26.78.77.80 Télécopie : 03.26.83.23.79 e-mail: pharmacovigilance@chu-reims.fr |